大腸桿菌摩打的構建精巧神奇
文章來源: Creation 44(1):42–45, 2022年1月

您可知道「簡單的」大腸桿菌要在我們的腸道中游走,得用上精密的納米級摩打呢?而每一個這樣的摩打,都可以高達每分鐘 22,800 轉的超速旋轉它的鞭毛 flagellum(某些細菌【摩打】的轉速更高達每分鐘 102,000 轉!1)。其所旋轉的鞭毛就作為螺旋槳。大腸桿菌的摩打寬約有四十五納米(納米為十億分之一米)—— 要平排上二千個才有人類頭髮那麼粗!進化論者稱之為「卓越非凡的納米機器」2、「精密的旋轉摩打」3,以及「分子機械工程中的精緻典範」4。
摩打零件
它的摩打零件所發揮的功能,與人類所設計的摩打零件相似。其中包括:齒輪、轉子、軸、驅動軸、軸襯【或稱:絕緣套】、萬向節及轉接環(圖一)。而且,就像我們的摩打一樣,細菌鞭毛是由電力驅動的。細菌的細胞膜充當作高效的電容器,將正電荷和負電荷分開。這種電差是由「質子泵」所產生:它吸收氫離子(質子)並將它們從細胞中抽出去。隨後,這些正電荷粒子流回細胞之內,便成為電流(與我們家用的電流相比並沒兩樣,只不過家用的電流是負電荷的電子流罷了)。而當這些質子流經鞭毛的摩打時,就會使它旋轉。詳情是這樣的:在大腸桿菌摩打的底部有一個中央齒輪,周圍最多可配有十一個電動齒輪【譯按:這些電動齒輪的作用如「定子」。為求文章簡潔,如下均稱作:定子】(在其他具鞭毛的細菌種類內,周圍定子的數量則可多達十八個);定子都有軸固定在細胞壁上,其齒輪以其軸為中心去旋轉;當流經定子的「電流」使其齒輪旋轉時,就會帶動那個中央齒輪旋轉。

轉子(圖二)則把那個中心齒輪連接到驅動軸上:而它本身是由內環、外環、轉接環,再加上一個用來套着驅動軸的套筒,所組合而成的。
驅動軸再通過作為絕緣套的蛋白環穿插到細胞外面去。而驅動軸的外面和絕緣套的裏面都很光滑,並有一層薄薄的液體將它們隔開。這樣的絕緣套是個「最佳設計」5 ,可讓驅動軸以極微的摩擦力旋轉,那樣摩打的效能就幾乎達至百分之一百了。
鉤形的萬向節就約有一百二十個活動部件,每個部件都是極為精細巧究的蛋白,可在旋轉之時順暢地伸縮。這樣的設計能非常有效地避免被扭歪掉,但要彎曲起來時卻又非常靈活,而這正正是高效萬向節所需的兩個關鍵條件。
變速換檔機關
【大腸桿菌】的摩打有兩種變速換檔的機關;一個是用來切換旋轉的方向,另一個是用來調節功率的輸出。首先,通過改變中央齒輪頂部的直徑,摩打就可以在不到一毫秒的時間內,切換於「前進」和「倒退」兩個檔之間(圖三)。

第二個變速換檔的運作機理則與單車所用的相同。當細胞遊進較濃稠的液體之中,要轉動螺旋槳就會變得更吃力;使用力矩感應器,摩打就自然會覺察得到,繼而自動讓更多個定子與中央齒輪嚙合,好增強摩打的轉動力6。若細胞遊進較為稀薄的液體的話,其操作則會倒轉過來。這樣精密的變速換檔機理使整個系統極為節能;因為除了所需要的功率,它並沒有用掉任何多餘的能量。
大腸桿菌的導航系統
若是沒法駕馭整個細胞,即使擁有這般神奇的摩打,多半都只會是得物無所用。 【好在大腸桿菌的】細胞具有一個系統能「極為精準」地掃描出其周遭化學分子之擴散率,好為它在所身處的環境中導航1。通過切換任何五至十個鞭毛摩打的轉向,這個導航系統就能夠令細胞改變航行的方向。
該系統精密的信號儀器裝置2擁有一個既美觀且組織嚴謹的六角形架構(圖四)。儀器前端排置有大量的感應器,用來探測不同的化學物質,而數以千計來自這些感應器的二元輸入信號,就是由它來作出運算的。這個儀器裝置的電路系統還設有一個短期記憶反饋迴路,好讓它去比較化學物質濃度隨著時間過去而有的變化。不同類型的感應器還會互相溝通來放大信號,可達五十倍之高。這些特性使導航系統具有高度靈敏性,其活動幅度龐大,而它放大信號的能力亦相當驚人3。 然而,大腸桿菌的導航系統算是細菌之中較為簡單的了;大多數其他的【系統】就還要複雜得多4。

參考文獻
- Gao, Q. and 2 others, Conformational shifts in a chemoreceptor helical hairpin control kinase signaling in Escherichia coli, pnas.org, 17 Jul 2019.
- Hazelbauer, G. and 2 others, Bacterial chemoreceptors: high-performance signaling in networked arrays, sciencedirect.com, 14 Sep 2007.
- Liu, J. and 5 others, Molecular architecture of chemoreceptor arrays revealed by cryoelectron tomography of Escherichia coli minicells, pnas.org, 5 Jun 2012.
- Porter, S. and 2 others, Rhodobacter sphaeroides: complexity in chemotactic signalling: cell.com, 1 Jun 2008.
摩打的打造
要打造出複雜精密的大腸桿菌靴毛摩打,就遠遠比摩打本身來得更為複雜;因為這需要大量的機械、各種電機和蛋白去製造、運輸,及組裝好靴毛摩打的每個零件,所有事都必需在特定的時間點配合得精確到位。除了需要有個複雜的系統去搜索出「鞭毛」基因的位置,並通過轉錄(transcription)及翻譯(translation)去合成所需要的蛋白之外,細胞還必須:
- 生產化學燃料 (ATP),來為許多負責組裝的機械提供能源
- 將新製造的蛋白運送給輸出器,並在運輸途中保存它們
- 在細胞壁上砌出一個孔洞好讓驅動軸穿出去,但同時又必須確保細胞不會因此而破裂
- 構建臨時支架以協助其他蛋白的組裝。
而這些都只是【針對打造摩打這個作業】來從頭說起。其中許多任務並不能單靠一台機械去完成,而是需要多台機械沿著複雜的生產線去協作。還有其中的某些機械,就會需要具有校對的系統,來檢查其製作程序及品質,有時還得調動其他維修機器去修復所發現的錯誤。
製造出來的蛋白又得帶有標籤,用來識別、分類和輸送它們。輸出器必須控制每隻蛋白交收的時間,那麼它就得從蛋白生產線的起點開始與線上每一台機械都溝通好,這才不會做成【任何半成品】的積壓。輸出器亦要內置一個會旋轉的電機,用來拆解開蛋白鏈。之後,在場組裝的其他機械則須將各樣蛋白重新折疊重組到位。
大腸桿菌靴毛摩打的打造可分為三個階段。在第一階段,基因計算程式(圖五)會從感應器輸入大量信息,而這些感應器則會測出細胞所身處的酸鹼度、含氧量、溫度、鹽度,以及其他環境因素;再加上來自其他細菌細胞的通信信號。計算程式就以這樣的信息流來決定:在當下的狀況是否應該去製造鞭毛。若然,接下來就要組裝【鞭毛】的摩打和鉤形萬向節的核心結構;然後【編織出】螺旋槳、組裝導航系統和定子。而第二階段的最後一步就是構建鉤形萬向節,為了最有效地運作,鉤形萬向節的長度必須為五十五納米7。【最後】在製作的同時,輸出器會用分子尺來量度出萬向節的長度。
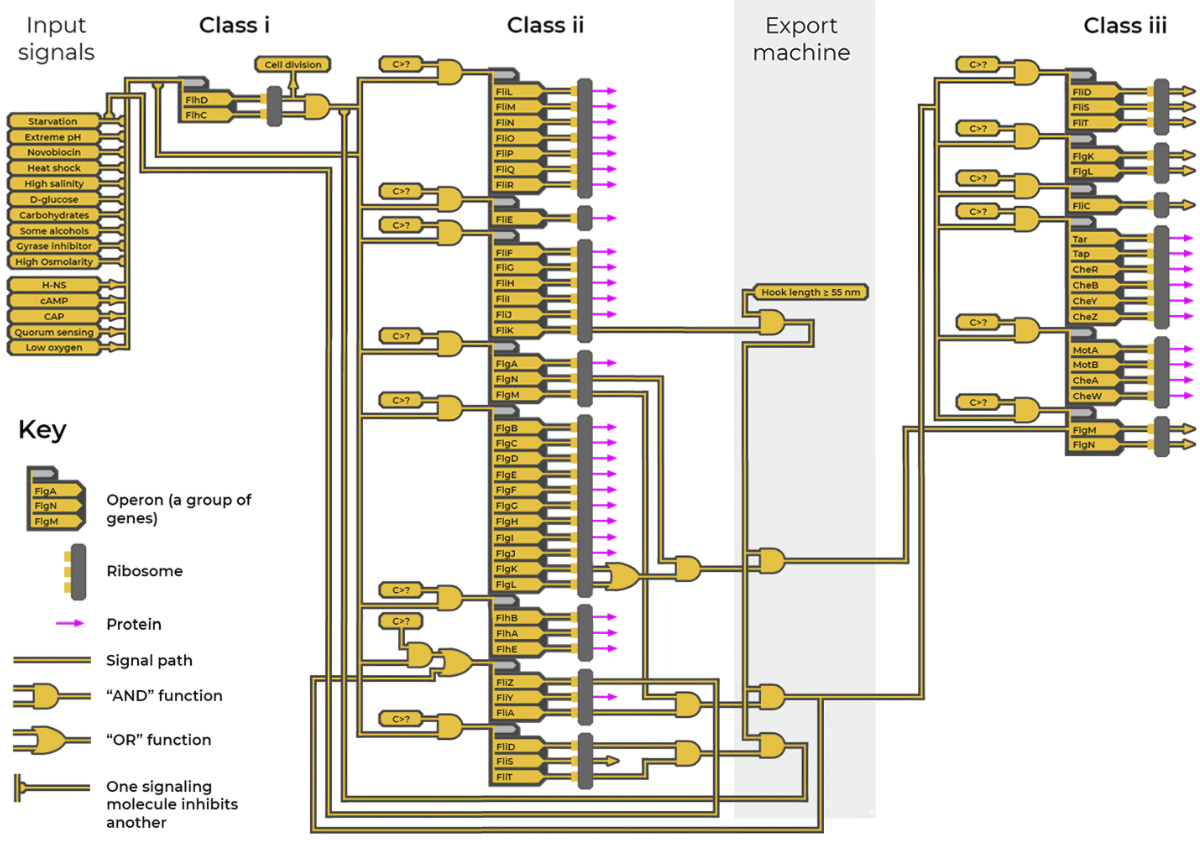
以基因計算程式去監督建造

打造過程的物流和時間安排則由另一個複雜的程式去監督(圖五8)。而這個基因計算程式的運作就有如計算機程式那樣,它所具備的功能包括: 電路圖、前饋控制與反饋的迴路、信號的輸入與輸出,以及邏輯門等。
基因計算程式共包含五十多個基因,而這些基因會分成一組一組(就是各個操縱組,英語為 operons),而這些操縱組又進一步分為三個級別。基因本身是製造特定蛋白的說明書。從一個基因產生出來的蛋白會引發程式中其他基因的啟動或關閉,形成基因電路圖; 而生產不同蛋白的先後次序,則是根據組裝場地當下所需而定。
無可能是進化出來的
儘管有明顯的設計證據,許多進化論者仍堅稱鞭毛摩打是由隨機突變加上天擇而進化出來的。進化論者曾堅稱鞭毛是從三型分泌系統(T3SS——英文版原文為 injectisome:顧名思義,其形狀結構有如注射針筒的針嘴,用於將【細菌細胞的】蛋白注入其他細胞之內)進化而來的。縱使現在這說法基本上已被否定,一些教科書中仍是如此教導學生的;如今一般認為三型分泌系統是由鞭毛因着基因的丟失而演化出來。然而,最近發表於二〇二一年四月的一篇論文9卻對這兩種說法都提出了挑戰。它比較了兩者的原子級結構,發現它們「顯然不同」;那麼,若要從其中一個進化成另一個,就會遠遠比以往所想像的還要困難了。
關於它的研究,最近就有一則新聞稿指出:「對於生物進化學家來說,鞭毛…永遠是個謎。這個『分子機器』由許多不同的配件所組成,而對於鞭毛的運作來說,所有這些配件都是必不可少的。要不是同時發明所有必要的配件,反而以講求漸進的達爾文理論去推演,哪怎有可能建造得出這樣的結構來呢?」 10
結論
相較大腸桿菌的這個摩打,許多其他細菌種類的摩打還更為複雜:它們有更多的零部件,有的還包括離合器(clutch)11或制動器(brake)12。 本文中的許多細節都是在最近幾年才發現出來的。毫無疑問,在未來的年日裏,將會有更多有趣的發現。細菌絕不是個「簡單的化學袋囊」,【它本身要比這種說法精巧高超得多】。大腸桿菌摩打的功能、操控及打造,都展示出重重精密的設計與工程工序。這台摩打就為它的設計者、我們的創造主:耶穌基督,帶來了榮耀頌讚(歌羅西書 1:16 )。
圖一:
除非另有說明(見下),蛋白結構均來自 RCSB Protein Data Bank (rcsb.org);並使用 Mol* 來製作蛋白的圖象 (D. Sehnal, S. Bittrich, M. Deshpande, R. Svobodová, K. Berka, V. Bazgier, S. Velankar, S.K. Burley, J. Koča, A.S. Rose (2021). Mol* Viewer: modern web app for 3D visualization and analysis of large biomolecular structures. Nucleic Acids Research. doi.org/10.1093/nar/gkab314).
PDB ID: 6SCN, Johnson, S., Fong, Y.H., Deme, J.C. et al. (2020). Symmetry mismatch in the MS-ring of the bacterial flagellar rotor explains the structural coordination of secretion and rotation. Nat Microbiol, 5, 966–975 (2020). doi.org/10.1038/s41564-020-0703-3
PDB ID: 6K3I, Shibata, S., Matsunami, H., Aizawa, SI. et al. (2019). Torque transmission mechanism of the curved bacterial flagellar hook revealed by cryo-EM. Nat Struct Mol Biol, 26, 941–945. doi.org/10.1038/s41594-019-0301-3
PDB ID: 5WJY, Wang, F., Burrage, A.M., Postel, S. et al. (2017). A structural model of flagellar filament switching across multiple bacterial species. Nat Commun, 8, 960. doi.org/10.1038/s41467-017-01075-5
PDB ID: 2ZVY, Kojima, S., Imada, K., Sakuma, M., Sudo, Y., Kojima, C., Minamino, T., Homma, M. & Namba, K. (2009). Stator assembly and activation mechanism of the flagellar motor by the periplasmic region of MotB. Molecular Microbiology, 73, 710-718. doi.org/10.1111/j.1365-2958.2009.06802.x
PDB ID: 6YSL, Deme, J.C., Johnson, S., Vickery, O. et al. (2020). Structures of the stator complex that drives rotation of the bacterial flagellum. Nat Microbiol, 5, 1553–1564. doi.org/10.1038/s41564-020-0788-8
PDB ID: 7CLR, Yamaguchi, T., Makino, F., Miyata, T. et al. (2021). Structure of the molecular bushing of the bacterial flagellar motor. Nat Commun, 12, 4469. doi.org/10.1038/s41467-021-24715-3
PDB ID: 7E80, Tan, J., Zhang, X., Wang, X., Xu, C., Chang, S., Wu, H., Wang, T., Liang, H., Gao, H., Zhou, Y., & Zhu, Y. (2021). Structural basis of assembly and torque transmission of the bacterial flagellar motor. Cell, 184(10), 2665–2679.e19. doi.org/10.1016/j.cell.2021.03.057
PDB ID: 3CX5, Solmaz, S. R., & Hunte, C. (2008). Structure of complex III with bound cytochrome c in reduced state and definition of a minimal core interface for electron transfer. The Journal of biological chemistry, 283(25), 17542–17549. doi.org/10.1074/jbc.M710126200
中央齒輪的圖像 (經過修改、裁剪及顏色的更換) 則根據 Creative Commons Attribution License (creativecommons.org/licenses/by/4.0/)的條款取材使用,源自:Brittany, L., C., Nishikino, T., Guo, W., Zhu, S., Kojima, S., Homma, M., & Liu, J. (2020). The flagellar motor of Vibrio alginolyticus undergoes major structural remodeling during rotational switching. eLife, 2020;9:e61446. doi.org/10.7554/eLife.61446
鉤形萬向節及靴毛髮絲束的圖像 (經過修改、裁剪及顏色的更換) 同樣根據 Creative Commons Attribution License 的條款取材使用,源自:Green, A.G., Elhabashy, H., Brock, K.P. et al. (2021). Large-scale discovery of protein interactions at residue resolution using co-evolution calculated from genomic sequences. Nat Commun, 12, 1396. doi.org/10.1038/s41467-021-21636-z
圖二:
轉子蛋白複合結構來自 RCSB Protein Data Bank (rcsb.org);並使用 Mol* 來製作蛋白的圖象 (D. Sehnal, S. Bittrich, M. Deshpande, R. Svobodová, K. Berka, V. Bazgier, S. Velankar, S.K. Burley, J. Koča, A.S. Rose (2021). Mol* Viewer: modern web app for 3D visualization and analysis of large biomolecular structures. Nucleic Acids Research. doi.org/10.1093/nar/gkab314).
PDB ID: 6SCN, Johnson, S., Fong, Y.H., Deme, J.C. et al. (2020) Symmetry mismatch in the MS-ring of the bacterial flagellar rotor explains the structural coordination of secretion and rotation. Nat Microbiol, 5, 966–975. doi.org/10.1038/s41564-020-0703-3
參考文獻及註解
- Magariyama, Y. and 6 others, Very fast flagellar rotation. Nature 371:752, 1994. 回到內文。
- Chang, Y. and 8 others, Molecular Mechanism for Rotational Switching of the Bacterial Flagellar Motor. Nature Structural & Molecular Biology, nature.com, 7 Sep 2020. 回到內文。
- Baker, M. and 16 others, Domain-swap polymerization drives the self-assembly of the bacterial flagellar motor,. Nature Structural & Molecular Biology, nature.com, 8 Feb 2016. 回到內文。
- Apel, D. and Surette, M.G., Bringing order to a complex molecular machine: The assembly of the bacterial flagella, BBA Biomembranes, sciencedirect.com, Sep 2008. 回到內文。
- Yamaguchi, T. and 5 others, Structure of the molecular bushing of the bacterial flagellar motor, Nat. Commun., nature.com, 22 Jul 2021. 回到內文。
- Baker, A. and O’Toole, G., Bacteria, rev your engines: stator dynamics regulate flagellar motility, Journal of Bacteriology, journals.asm.org, 25 May 2017. 回到內文。
- Spöring I. and 13 others, Hook length of the bacterial flagellum is optimized for maximal stability of the flagellar bundle, journals.plos.org, 6 Sep 2018. 回到內文。
- Fitzgerald, D. and 2 others, Comprehensive Mapping of the Escherichia coli Flagellar Regulatory Network, journals.plos.org, 2 Oct 2014. 回到內文。
- Buggs, R., More obsolete Dawkinsian evidence for evolution, natureecoevocommunity.nature.com, 4 May 2021. 回到內文。
- Dunning, H., Team investigating the evolution of bacterial ‘tails’ wins prestigious grant, imperial.ac.uk, 12 Apr 2021. 回到內文。
- Sarfati, J., Germ with seven motors in one!, creation.com/germ-7-motors-in-1, 15 Jan 2013. 回到內文。
- Pilizota, T. and 5 others, A molecular brake, not a clutch, stops the Rhodobacter sphaeroides flagellar motor, pnas.org, 14 Jul 2009. 回到內文。

Readers’ comments
Comments are automatically closed 14 days after publication.